
Рефераты по коммуникации и связи
Рефераты по косметологии
Рефераты по криминалистике
Рефераты по криминологии
Рефераты по науке и технике
Рефераты по кулинарии
Рефераты по культурологии
Рефераты по зарубежной литературе
Рефераты по логике
Рефераты по логистике
Рефераты по маркетингу
Рефераты по международному публичному праву
Рефераты по международному частному праву
Рефераты по международным отношениям
Рефераты по культуре и искусству
Рефераты по менеджменту
Рефераты по металлургии
Рефераты по налогообложению
Рефераты по оккультизму и уфологии
Рефераты по педагогике
Рефераты по политологии
Рефераты по праву
Биографии
Рефераты по предпринимательству
Рефераты по психологии
Рефераты по радиоэлектронике
Рефераты по риторике
Рефераты по социологии
Рефераты по статистике
Рефераты по страхованию
Рефераты по строительству
Рефераты по схемотехнике
Рефераты по таможенной системе
Сочинения по литературе и русскому языку
Рефераты по теории государства и права
Рефераты по теории организации
Рефераты по теплотехнике
Рефераты по технологии
Рефераты по товароведению
Рефераты по транспорту
Рефераты по трудовому праву
Рефераты по туризму
Рефераты по уголовному праву и процессу
Рефераты по управлению
Реферат: Алифатические амины
Реферат: Алифатические амины
Алифатические амины
Амины - производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Амины классифицируют по числу атомов водорода, замещенных на углеводородные радикалы. Различают первичные R-NH2, вторичные R2-NH и третичные R3-N амины.
Известны и соединения с четвертичным атомом азота - соли аммония - R4N+X-. В этом случае азот несет положительный заряд.
В зависимости от типа радикала различают алифатические и ароматические амины:
CH3NH2 CH3CH2NH2 CH2=CH-CH2-NH2 С6H5-NH2
Амины жирного ряда (алифатические амины)
Изомерия в ряду алифатических аминов связана с изомерией углеводородного радикала и количеством заместителей у атома азота.
Многие амины имеют тривиальные названия. По рациональной номенклатуре названия аминов образуются из названий углеводородных остатков, связанных с атомом азота и окончания -амин:
(CH3)2CH-NH2 (CH3)2CHCH2-NH2 CH3-NH-CH2CH3
изопропиламин изобутиламин метилэтиламин
По номенклатуре IUPAC для простых аминов используют рациональные названия. По правилам IUPAC к названию углеводородного радикала добавляют окончание -амин. Углеводородная цепь начинается с атома углерода, соединенного с аминогруппой: CH3CH2CH2CH-NH-CH3 1-метилбутиламин. При наличии других функциональных групп аминогруппа обозначается приставкой: NH2-CH2CH2-OH – 2-аминоэтанол.
Способы получения алифатических аминов
1. Аммонолиз галогеналканов.
При нагревании галогеналканов со спиртовым раствором аммиака в запаянных трубках образуется смесь соединений. При взаимодействии аммиака с галогеналканами образуются первичные алкиламины. Моноалкиламины являются более сильными нуклеофилами, чем аммиак; они будут дальше реагировать с галогеналканом, давая значительные количества вторичных и третичных аминов и даже четвертичные соли аммония:
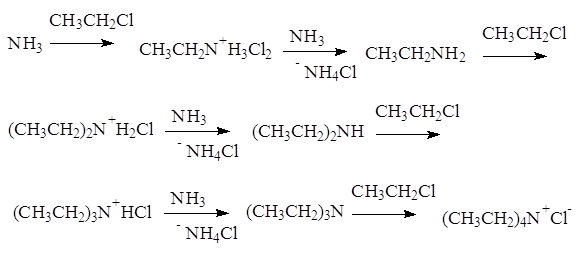
Аммонолиз галогенпроизводных относится к реакциям нуклеофильного замещения. В частности, реакция CH3CH2Cl+NH3 протекает по механизму:
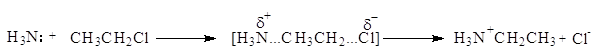
Поэтому первичные амины получают обычно другими способами.
2. Аммонолиз спиртов.
Состоит в замещении атомов водорода в аммиаке или амине на алкильные группы. Это важнейший способ синтеза аминов:
CH3OH + NH3 ® CH3NH2 + H2O
Аммонолиз спиртов реализован в значительных масштабах для синтеза низших алифатических аминов (метил- и этиламины). Они применяются в качестве топлива для жидкостных ракетных двигателей и как промежуточные продукты органического синтеза (получение других аминов, диметилгидразина, анионоообменных смол и анионоактивных веществ, пестицидов, карбаматов и дитиокарбаматов).
3. Синтез Габриэля.
Синтез Габриэля позволяет получать первичные амины, свободные от более высокоалкилированных продуктов. Алкилирование фталимида калия по механизму SN2 дает N-алкилфталимид, который можно легко гидролизовать до соответствующего амина:
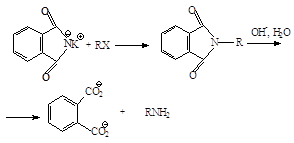
Фталимид получают при нагревании фталевого ангидрида с аммиаком:
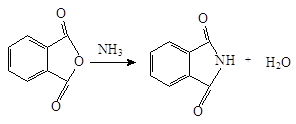
Фталимид обладает кислотными свойствами из-за делокализации отрицательного заряда имид-аниона на двух ацильных атомах кислорода. Он теряет протон, связанный с азотом, при взаимодействии с основанием типа гидроксида калия. В результате этой реакции образуется фталимид-ион – анион, который стабилизируется:
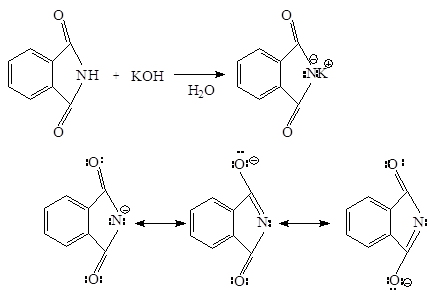
4. Восстановительное аминирование карбонильных соединений
Многие карбонильные соединения превращаются в амины в процессе восстановления в присутствии аммиака. Восстановление осуществляется либо каталитическим гидрированием, либо с помощью цианборгидрида натрия NaBH3CN. Механизм этой реакции включает две важные стадии: образование имина и восстановление имина в амин:
R-COH + NH3 « RH-C=NH + H2O ® RH2-C-NH2
CH3(CH2)5CHO + NH3 ® CH3(CH2)6-NH2
Если вместо аммиака использовать первичный амин, то продуктом реакции будет вторичный амин.
5. Восстановление нитроалканов, оксимов, нитрилов, амидов
Азотсодержащие соединения (нитроалканы, оксимы, амиды, нитрилы и изонитрилы) под действием водорода или других восстановителей дают либо первичные амины, либо вторичные, либо их смесь:
R-NO2 + 3 H2 ® R-NH2 + 2 H2O
R-CN + 2 H2 ® R-NH2 + 2 H2O
R-NC + 2 H2 ® R-NH-CH3
Катализаторы – Pt, Pd, Ni.
3. Расщепление амидов кислот (перегруппировка Гофмана).
Амиды алифатических и ароматических карбоновых кислот реагируют со щелочными растворами иода, брома или хлора с образованием первичных аминов. Это так называемая гипогалогенитная реакция Гофмана позволяет не только синтезировать первичные амины, но и укорачивать углеродную цепь на один атом.
Br2 + H2O + RC(O)NH2 + 2 OH - ® R-NH2 + CO2 + 2 H2O + 2 Br-
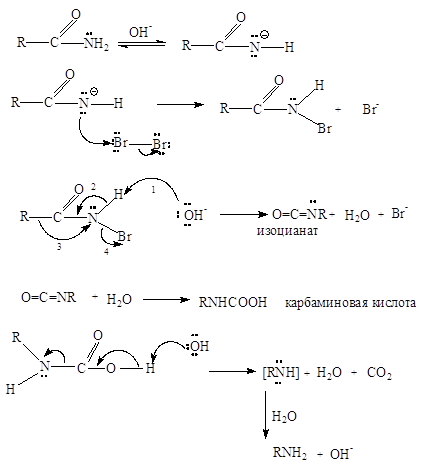
Сначала из стабилизированного резонансом амид-иона образуется N-галогензамещенный амид (здесь N-бромамид), который в щелочном растворе неустойчив и превращается в изоцианат.
Изоцианаты, так же как их углеродные аналоги (кетены), быстро реагируют с водой. Продукт гидратации, карбаминовая кислота, легко декарбоксилируется с образованием амина.
7. Перегруппировка Курциуса.
Хлорангидриды кислот, взаимодействуя с азидом натрия NaN3, дают ацилазиды (азиды кислот), которые при нагревании превращаются в изоцианаты:
R-CO-Cl + NaN3 ® R-CO-N-NºN
Превращение ацилазидов в изоцианаты, как показано ниже, представляет собой согласованный процесс. Эта реакция носит название перегруппировки Курциуса:
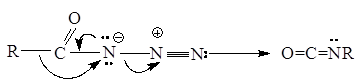
Затем изоцианаты реагируют с водой и образуются амины:
O=C=N-R + H2O ® CO2 + R-NH2
Первичные и вторичные амины способны образовывать межмолекулярные водородные связи. Поэтому амины имеют более высокие температуры кипения, чем неполярные соединения с той же молекулярной массой. Спирты и карбоновые кислоты образуют более прочные водородные связи, чем амины. Поскольку третичные амины не содержат водородных атомов при атоме азота, они не образуют водородных связей.
Низкомолекулярные амины смешиваются с водой в любых соотношениях.
Алифатические амины. Ароматические амины
Химические свойства аминов
1. Реакции аминов с кислотами
R-NH2 + HCl ® R-NH3+Cl -
Эти соли при взаимодействии с водными растворами оснований выделяют амины.
Основность аминов определяется легкостью, с которой амин отщепляет протон от воды.
2. Алкилирование аминов галогеналканами - см. Лекцию №31. На последней стадии образуются четвертичные соли аммония - четыре органических группы ковалентно связаны с азотом, положительный заряд уравновешен наличием отрицательного иона:
2 RN+X- + Ag2O + HOH ® 2 AgX¯ + OH- + 2 RNOH « R4N+
Четвертичные аммониевые основания (белые кристаллические вещества) по основности сопоставимы с NaOH, KOH.
4. Ацилирование аминов (получение амидов).
Первичные и вторичные амины реагируют с ангидридами и галогенангидридами кислот с образованием амидов:
CH3CH2NH2 + CH3COCl ® CH3CO-NH-CH2CH3 + HCl
(CH3)2NH + (CH3CO)2O ®(CH3)2N-COCH3 + CH3COOH
Замещенные амиды называют как производные незамещенных амидов карбоновых кислот.
Образующаяся в ходе реакции кислота связывает эквивалентное количество непрореагировавшего амина. Такой метод становится неэкономичным, если амин трудно синтезировать или он представляет собой дорогостоящий реактив. Поэтому амины часто ацилируют по реакции Шоттен-Баумана, которая заключается во взаимодействии амина и ацилирующего агента в присутствии водного раствора едкого натра:
(CH3)2C-CH2-COCl + R2-NH + OH- ® (CH3)2C-CH2-CO-N-R2 + HCl
Ароматические амины
Ароматические амины могут быть первичными ArNH2 (анилин, толуидины), вторичными Ar2NH (дифениламин), и третичными Ar3N (трифениламин).
Способы получения ароматических аминов
1. Восстановление нитросоединений (реакция Зинина).
В качестве восстановителей используются железо и соляная или серная кислота, олово и соляная кислота, сероводород и сернистые щелочи, гидросульфиты, водород в присутствии катализаторов. Восстановление также можно осуществить электролитически.
Ar-NO2 + 2H2 ® Ar-NH2 + 2H2O
В зависимости от характера среды восстановление идет разными путями. В кислой среде в качестве промежуточных продуктов образуются нитрозосоединения и производные гидроксиламина. Последние могут быть получены как конечные продукты при восстановлении в нейтральной среде. В щелочной среде процесс идет более сложно. Вслед за нитрозосоединениями получаются азоксисоединения, затем азосоединения, гидразосоединения и, наконец, амины.
2. Аммонолиз арилгалогенидов (алкилирование аммиака арилгалогенидами).
Ароматические амины получают из арилгалогенидов и аммиака:
ArCl + 2 NH3 ® Ar-NH2 + NH4Cl
Вследствие малой подвижности галогена реакцию приходится вести при высоких давлениях и температурах в присутствии катализаторов - меди и ее солей. Только в тех случаях, когда в о- или п-положении к галогену находится сильно электроотрицательные группы, например, нитрогруппа, галоген легко замещается на аминогруппу.
3. Реакция Гофмана.
Ароматические амины могут также быть получены из кислот через амиды по реакции Гофмана (см. Лекцию№31).
4. Получение вторичных ароматических аминов.
Ароматические вторичные амины получают нагреванием ароматических аминов с их солями:
Ar-NH2 + Ar-NH2×HCl ® Ar2NH + NH4Cl
Вторичные жирноароматические амины получают алкилированием первичных ароматических аминов галогенпроизводными или спиртами.
5. Третичные амины.
Третичные ароматические амины получают алкилированием или арилированием первичных или вторичных аминов:
C6H5-NH2 + 2 CH3OH ® C6H5-N(CH3)2 + 2 H2O
Менее доступные третичные ароматические амины получают нагреванием вторичных аминов с арилиодидами в присутствии медного порошка:
(C6H5)2-NH + C6H5J ® (C6H5)3N + HJ
Химические свойства ароматических аминов
Ароматические амины имеют менее выраженный основный характер, чем алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра - их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять протон.
Присутствие электроноакцепторных групп в ядре уменьшает основность. Например, константа основности для о-, м- и п-нитроанилинов составляет соответственно 1×10-14, 4×10-12 и 1×10-12.. Ведение второго ароматического ядра также заметно уменьшает основность (для дифениламина Kb=7,6×10-14). Дифениламин образует сильно гидролизующиеся в растворах соли только с сильными кислотами. Трифениламин основными свойствами практически не обладает.
С другой стороны, введение алкильных групп (электронодонорные группы) увеличивает основность (Kb N-метиланилина и N,N-диметиланилина равны соответственно 7,1×10-10 и 1,1×10-9
1. Алкилирование ароматических аминов.
Ароматические амины способны замещать водород аминогруппы на алкилы. Эта реакция приводит ко вторичным и третичным аминам:
C6H5NH2 + CH3J ® C6H5NH-CH3 + CH3J ® C6H5N-(CH3)2
Алкилирование ведут спиртами или хлоралканами, в качестве катализаторов используют соли одновалентной меди в виде аммиачных комплексов. Важно, что процесс N-алкилирования является последовательно-параллельным, обусловленный тем, что образовавшийся амин, в свою очередь, способен реагировать с алкилирующим агентом. Состав продуктов зависит от соотношения реагентов.
2. Ацилирование ароматических аминов.
При действии ацилирующих агентов (кислоты, ангидриды, хлорангидриды) водородные атомы аминогруппы замещаются на ацильные остатки.
C6H5NH2 + (CH3CO)2O ® C6H5NHCO-CH3 + CH3COOH
C6H5NH2 + CH3COOH ® C6H5NH2×HOCOCH3®C6H5NHCO-CH3 + H2O
Ацильные производные не обладают основными свойствами. Они обладают устойчивостью к окислителям и потому используются в качестве промежуточных веществ в реакциях аминов в присутствии окислителей (например, нитрование).
3. Синтез азометинов (оснований Шиффа).
При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко образуются так называемые основания Шиффа или азометины:
C6H5NH2 + C6H5COH ® C6H5N=CH-C6H5 + H2O
Под действием разбавленных кислот основания Шиффа гидролизуются до альдегида и амина.
4. Реакции аминов с азотистой кислотой.
Азотистая кислота HONO неустойчива, но ее водный раствор можно получить, растворив нитрит натрия, при охлаждении в разбавленной кислоте, например, соляной.
Первичные алифатические амины реагируют с холодным водным раствором азотистой кислоты с образованием алкилдиазониевых солей, при разложении которых образуется смесь разнообразных продуктов:
CH3CH2CH2-NH2 + HONO ® [CH3CH2CH2N2+] ® [CH3CH2CH2+] + H2O ® CH3CH2CH2-OH + CH3CH(OH)CH3 + CH3CH=CH2 + (CH2)3
Вторичные алифатические амины реагируют с азотистой кислотой с образованием N-нитрозоаминов желтого цвета. Эти соединения, амиды азотистой кислоты, являются очень слабыми основаниями.
(CH3)2NH + [HONO] ® (CH3)2N-N=O
N-нитрозодиметиламин (канцероген!)
При взаимодействии третичных алкиламинов с азотистой кислотой образуются сложные смеси.
Важнейшие представители ароматических аминов
Анилин впервые был получен в результате перегонки индиго с известью (1826г.). В 1842 г. его получил Зинин восстановлением нитробензола. В незначительных количествах содержится в каменноугольной смоле. В промышленности получают из нитробензола каталитическим гидрированием с медным катализатором в газовой фазе. Анилин в больших количествах идет на получение красителей, циклогексиламина, капролактама, пестицидов и др.
п-Толуидин широко применяется в производстве красителей, особенно фуксина.
N,N-диметиланилин применяется в производстве красителей и взрывчатых веществ.